

Mange kjemiske prosesser er avhengig av at pH i miljøet ikke forandres mye selv om den påvirkes sterkt av sure og basiske stoffer. Vår egen kropp har flere buffersystemer som nettopp beskytter oss mot uønskede store pH forandringer. Blodet har et slikt system av CO2 og bikarbonat HCO3+ som holder pH konstant mellom 7,3 og 7,4 selv om avfallstoffer fra cellene og stoffer fra tarm kan være sterkt sure eller basiske.
Her blir lungeluft blåst inn.

Hvorfor buffer?
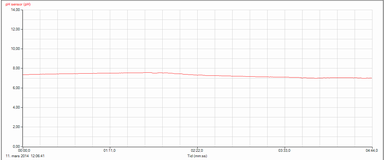
Natron eller bakepulver er et bikarbonat som kan brukes til å lage en buffer. Løs bittelitt natron ad gangen i 3 dl vann og mål pH til den nærmer seg 7,3. Pust ut lungeluft gjennom et sugerør i vannet. Lungeluft innholder CO2. Fortsett å måle pH mens du puster ut gjennom vannet. pH vil gradvis synke fordi CO2 i vann er en syre. Men pH vil forandre seg meget langsomt fordi bikarbonatet bufrer. pH fra 7,3 til 7,0. Det er slik i blodet også og da CO2 fra cellene forsvinner fra blodet i lungene blir bufferen stadig fornyet. Den nedre kurven er pH forandringen i rent vann når lungeluft blåses gjennom vannet. Forandring fra 6,5 til 5,5

